- Важность принципов в физике и химии
- Принцип Паули и запрета
- Основные принципы и их роль в физике
- Правила Хунда
- Применение правил Хунда в химии и физике
- Принцип Клечковского
- Роль принципа Клечковского в физике и химии
- Принцип Клечковского
- Значение в физике и химии
- Взаимосвязь принципов Паули, Хунда и Клечковского
- Как эти принципы взаимодействуют друг с другом
- Принцип запрета Паули и его значение в химии
В физике существуют некоторые основные принципы, которые играют важную роль в понимании различных явлений и взаимодействий в мире. Один из таких принципов — это принцип Паули, который имеет фундаментальное значение в квантовой механике. Этот принцип утверждает, что в атоме ни два электрона не могут находиться в одном и том же квантовом состоянии. Такая «запрета Паули» происходит из того факта, что электроны — фермионы, частицы с полуцелым спином, и они подчиняются принципу исключения Паули.
Еще один важный принцип, который играет важную роль в физике, это правила Хунда. Эти правила связаны с распределением электронов в электронных оболочках атома. Правила Хунда утверждают, что электроны заполняют энергетические уровни таким образом, чтобы минимизировать их взаимодействие и достичь наиболее устойчивой конфигурации. Согласно правилам Хунда, сначала заполняются энергетическое уровни с более низкой энергией, а затем с более высокой.
Помимо принципа Паули и правил Хунда, существует еще один важный принцип — принцип запрета Клечковского. Этот принцип, возникший в химии, утверждает, что некоторые электронные переходы запрещены, если они противоречат определенным правилам отбора. Таким образом, принцип запрета Клечковского позволяет предсказывать, какие электронные переходы в молекуле могут происходить, а какие нет. Этот принцип занимает важное место в изучении света и спектроскопии, позволяя анализировать спектры различных молекул и исследовать их химическую структуру.
Таким образом, принцип Паули, правила Хунда и принцип запрета Клечковского играют важную роль в физике и химии, помогая нам понять и объяснить различные явления, связанные с поведением электронов в атомах и молекулах. Эти принципы также являются основой для разработки теоретических моделей и прогнозирования свойств различных веществ. Благодаря их использованию мы можем лучше понять и объяснить сложные явления и реакции, которые происходят на микроуровне и оказывают влияние на макроуровне.
Важность принципов в физике и химии
В физике и химии существует множество принципов, которые играют важную роль в объяснении и понимании различных явлений. Один из таких принципов — принцип запрета Паули. Данный принцип устанавливает, что два электрона в атоме не могут иметь одинаковые квантовые числа. Такой запрет позволяет поддерживать стабильность и устойчивость атомов, так как запрещает возникновение электронных состояний с высоким энергетическим уровнем. Паули также предложил своим принципом объяснение фундаментального явления — закон Гунда, согласно которому не более двух электронов могут находиться в одном орбитальном состоянии.
Важность принципа запрета Паули связана с его широким применением в различных областях физики и химии. Например, он позволяет объяснить спиновую и статистическую природу фермионов, таких как электроны, и бозонов, таких как фотоны. Также принцип запрета Паули также играет важную роль в понимании свойств и взаимодействия атомов и молекул, а также в объяснении фазовых переходов и электронной структуры различных материалов.
Еще одним важным принципом в физике и химии является принцип минимума Клечковского. Этот принцип гласит, что любой физический процесс протекает таким образом, чтобы его энергия достигла наименьшего значения, при условии сохранения определенных величин. Данный принцип позволяет определить оптимальные условия для энергетических переходов и реакций, а также объясняет множество явлений, таких как оптические свойства веществ, магнитные и электромагнитные явления, кинетические процессы и тепловое равновесие.
Таким образом, принципы запрета Паули, Хунда и Клечковского играют важную роль в физике и химии, позволяя объяснить множество явлений и свойств материи. Их понимание и учет в научных исследованиях позволяет более глубоко и точно изучать различные системы и процессы в физическом и химическом мире.
Принцип Паули и запрета
Принцип Паули — это один из основных принципов в квантовой физике, сформулированный в 1925 году австрийским физиком Вольфгангом Паули. Он устанавливает, что в одной и той же квантовой системе не может существовать два или более электронов с полным мнимым спином, занимающих одно и то же квантовое состояние.
Принцип Паули является следствием частного случая более общего принципа запрета Паули. По сути, принцип запрета Паули ограничивает количество электронов, которые могут занимать одно и то же квантовое состояние, а принцип Паули указывает на то, что эти электроны также должны иметь разные спины.
Принцип Паули играет фундаментальную роль в описании структуры атомов, молекул и их свойств. Он объясняет множество явлений и свойств, таких как химическая связь, электронная конфигурация атомов и принцип электронного заполнения.
Вместе с остальными принципами и правилами, такими как правила Хунда и Клечковского, принцип Паули позволяет получить полное представление о распределении электронов в атомных оболочках и определить электронную структуру химических элементов.
Основные принципы и их роль в физике
Физика — это наука об устройстве и свойствах материи, ее движении и взаимодействии с энергией. Для понимания и описания физических явлений существуют различные принципы и правила, которые определяют основу физических законов.
Одним из основных принципов в физике является принцип запрета Паули. Согласно этому принципу, в одной квантовой системе два электрона не могут находиться в одной и той же квантовой состоянии, то есть иметь одинаковый комплект квантовых чисел. Такой запрет обусловлен спиновым свойством электрона и играет важную роль в объяснении строения атомов и молекул.
Еще одним важным принципом является правило Хунда, или правило заполнения орбиталей. Согласно этому правилу, электроны в атоме последовательно занимают свободные орбитали с наименьшей энергией. Это правило помогает определить электронную конфигурацию атомов и предсказать их химические свойства.
Кроме того, в химии используется правило Клечковского о невозможности одновременного определения точного значения импульса (или скорости) частицы и ее координаты. Согласно этому правилу, находящуюся в физической системе частиц невозможно одновременно точно определить их положение и импульс с максимальной точностью. Правило Клечковского является следствием основных принципов квантовой механики и ограничивает нашу возможность измерять и описывать микромиры.
Таким образом, эти основные принципы и правила являются фундаментальными в физике и химии, определяющими свойства и взаимодействия материи на микроуровне. Их роль состоит в объяснении и предсказании физических и химических явлений, а также разработке новых технологий и материалов на их основе.
Правила Хунда
В химии существуют определенные правила, регулирующие распределение электронов в энергетических уровнях атома. Эти правила, также известные как правила Хунда, определены на основе принципа Паули.
Принцип Паули утверждает, что внутри атома два электрона не могут иметь одинаковые квантовые числа. Это означает, что два электрона в одной орбитали должны иметь противоположный спин.
Правила Хунда указывают на то, как распределяются электроны в подуровнях энергетического уровня. Они основаны на наиболее стабильной конфигурации электронов в атоме.
Основные правила Хунда:
- Принцип минимальной энергии — электроны заполняют подуровни с низшей энергией сначала.
- Принцип максимальной мультипликации — электроны заполняют одиночные подуровни с одинаковой энергией по принципу Паули, прежде чем заполнять свободные места в подуровне с противоположным спином.
- Принцип неполноточности — каждый электрон имеет собственный магнитный момент и спин. Чтобы минимизировать их взаимодействие и сохранить энергетическую стабильность, электроны стараются занять разные орбитали с противоположными спинами.
Правила Хунда играют важную роль в объяснении структуры атомов и свойств химических элементов. Эти правила помогают предсказывать и объяснять параметры, такие как магнитные свойства и реакционную активность элементов.
Применение правил Хунда в химии и физике
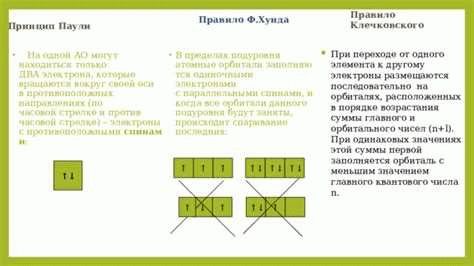
В химии и физике существует такой принцип, как принцип запрета Паули, который гласит, что для электронов в атомах и молекулах существует запрет на одновременное занимание одного и того же квантового состояния. Это означает, что электроны в атоме распределяются по разным энергетическим уровням и подуровням, чтобы учесть этот запрет. Именно здесь применяются правила Хунда.
Правила Хунда — это правила заполнения энергетических уровней и подуровней электронами. Они помогают определить порядок заполнения подуровней, чтобы удовлетворить принципу запрета Паули.
Основные правила Хунда включают:
- Правило минимальной энергии: энергетические уровни заполняются электронами по возрастанию энергии.
- Правило максимальной неупорядоченности: электроны предпочитают располагаться по отдельным орбиталям с одним спином, прежде чем начать заполнять орбитали с противоположным спином.
- Правило заполнения энергетических уровней: энергетические уровни и подуровни заполняются электронами в порядке возрастания их энергий.
Применение правил Хунда в химии и физике позволяет установить правильное распределение электронов по энергетическим уровням и подуровням атомов и молекул. Это важно для понимания химических и физических свойств вещества, так как распределение электронов влияет на его химическую и физическую активность.
Таким образом, правила Хунда являются важным инструментом в химии и физике для описания поведения электронов и определения их энергетического состояния. Их применение позволяет лучше понять взаимодействие атомов и молекул в химических и физических процессах.
Принцип Клечковского
Принцип Клечковского является одним из важных принципов в физике, который работает в паре с принципом запрета Паули.
Этот принцип формулируется следующим образом: «два фермиона (частицы со спином 1/2) не могут находиться в одном и том же квантовом состоянии». Другими словами, если две частицы имеют одинаковые квантовые числа (такие как энергия, момент импульса и др.), то они не могут существовать в одном и том же состоянии одновременно.
Принцип Клечковского назван в честь советского физика Фрида Клечковского, который в 1962 году предложил его формулировку. Он является следствием принципа Паули, который запрещает нахождение двух фермионов в одном и том же квантовом состоянии.
Принцип Клечковского имеет большое значение в физике элементарных частиц, так как он помогает объяснить структуру атомных ядер и других систем, состоящих из фермионов. Например, благодаря этому принципу мы понимаем, почему в атомных ядрах нуклоны (протоны и нейтроны) обладают разными квантовыми числами, что обеспечивает их стабильность и устойчивость.
Роль принципа Клечковского в физике и химии
Принцип запрета Паули играет важную роль в описании электронной структуры атомов и молекул. Однако существует еще один принцип, который имеет большое значение как в физике, так и в химии — это принцип Клечковского.
Принцип Клечковского
Принцип Клечковского, также известный как принцип запрета для парадоксальных кварков, был предложен советским физиком Михаилом Клечковским в 1962 году. Этот принцип утверждает, что два фермиона не могут находиться в одном и том же квантовом состоянии с одинаковыми значениями всех квантовых чисел (кроме спина).
Принцип Клечковского имеет свою аналогию с принципом Паули в физике электронов. В принципе Паули два электрона не могут занимать одно и то же квантовое состояние с одинаковыми значениями всех квантовых чисел (кроме спина). Аналогично, в принципе Клечковского два кварка не могут находиться в одном и том же квантовом состоянии с одинаковыми значениями всех квантовых чисел (кроме спина).
Значение в физике и химии
Принцип Клечковского оказывает существенное влияние на структуру и свойства атомных и ядерных систем. Он объясняет, почему кварки в протонах и нейтронах образуют странные состояния и не могут находиться в одном и том же квантовом состоянии.
В химии принцип Клечковского также имеет важное значение. Он объясняет, почему атомы и молекулы имеют определенный набор электронных конфигураций и почему они имеют свойства, определяющие их взаимодействие с другими веществами.
Принцип Клечковского является одной из основ физики и химии, позволяющей объяснить и предсказывать различные явления и свойства веществ. Он дополняет принцип Паули и помогает понять многочисленные аспекты структуры и взаимодействия частиц.
Взаимосвязь принципов Паули, Хунда и Клечковского
Принцип Паули, правила Хунда и Клечковского являются важными концепциями в физике и химии. Они описывают основные принципы взаимодействия элементов и атомов.
Принцип Паули, также известный как принцип запрета Паули, утверждает, что в одной атомной оболочке не может находиться более двух электронов с противоположными спиновыми состояниями. Это означает, что электроны в атоме должны занимать различные энергетические уровни (оболочки), чтобы избежать взаимного отталкивания силой одноименного заряда. Этот принцип играет важную роль в объяснении строения атомов и молекул.
Правила Хунда относятся к распределению электронов по энергетическим уровням. Они формулируются следующим образом:
- Принцип минимальной энергии — наиболее стабильное состояние атома достигается, когда электроны занимают энергетические уровни с наименьшей энергией.
- Принцип максимальной мультипликативности — если имеется несколько энергетических уровней с одинаковой энергией, то электроны будут заполнять каждый из этих уровней по одному, прежде чем начать заполнять их парными.
- Принцип заполнения — электроны в атоме заполняют энергетические уровни в порядке возрастания их энергии.
Правила Хунда объясняют, почему атомы и молекулы образуют определенные конфигурации и имеют специфические свойства.
Принцип Клечковского, впервые сформулированный советским физиком Клечковским, относится к распределению адронов (протонов и нейтронов) в ядерных оболочках атомов. Он утверждает, что адроны в ядерных оболочках заполняют энергетические уровни по аналогии с электронами в атомных оболочках. Этот принцип позволяет объяснить связь между свойствами атомных ядер и распределением адронов.
Таким образом, принцип Паули, правила Хунда и принцип Клечковского являются важными фундаментальными принципами в физике и химии, которые помогают объяснить строение атомов, молекул и ядерных оболочек.
Как эти принципы взаимодействуют друг с другом
Принципы Паули, Хунда и Клечковского являются важными основами в физике, особенно в контексте атомной и ядерной физики. Они также имеют влияние на области химии и квантовой механики.
Первым принципом, который необходимо рассмотреть, является принцип Паули. Он утверждает, что в атоме не может существовать двух электронов с одним и тем же набором квантовых чисел. Это означает, что каждый электрон в атоме должен иметь свой уникальный набор квантовых чисел — главного, орбитального, магнитного и спинового. Это объясняет, почему на каждой атомной орбитали может находиться не более двух электронов, имеющих противоположные спины. Принцип Паули играет важную роль в понимании строения атома и его свойств.
Принцип запрета Хунда дополняет принцип Паули. Он утверждает, что электроны в атоме заполняют энергетические уровни с наименьшей энергией в первую очередь, прежде чем перейти к более высоким уровням. Это значит, что электроны заполняют орбитали в одной электронной оболочке одиночными электронами, пока все орбитали с одиночными электронами не будут заполнены. После этого остальные электроны заполняют орбитали парами, чтобы обеспечить минимальное энергетическое состояние системы. Принцип запрета Хунда помогает объяснить, почему атомы стремятся к наиболее энергетически стабильным состояниям.
Наконец, принцип Клечковского, также известный как правило учета, объясняет, как состояние электрона связано с полным моментом импульса системы. Это правило заявляет, что полный момент импульса системы составлен из суммы моментов импульса всех электронов в атоме. Принцип Клечковского позволяет определить общий спин системы электронов и его значения.
Эти принципы тесно взаимосвязаны и взаимодействуют друг с другом. Принцип Паули определяет, как электроны распределяются по орбиталям, и благодаря этому обеспечивает энергетическую стабильность атома. Принцип запрета Хунда дополняет принцип Паули, определяя порядок заполнения орбиталей. Принцип Клечковского позволяет определить полный момент импульса системы электронов, что помогает понять его магнитные свойства и спин. Вместе эти принципы обеспечивают фундаментальное понимание строения атомов, молекул и других систем в физике и химии.
Принцип запрета Паули и его значение в химии
Принцип запрета Паули является одним из фундаментальных принципов в физике частиц и имеет важное значение в химии. Этот принцип был разработан физиком Вольфгангом Паули в 1925 году и является частью более общей теории квантовой механики.
Суть принципа заключается в следующем: нельзя иметь две или более частицы, находящиеся в одном и том же квантовом состоянии. Более точно, две частицы не могут иметь одинаковые значения всех квантовых чисел. Квантовые числа определяют основные характеристики частицы, такие как энергия, момент импульса и спин.
Этот принцип обуславливает структуру электронных оболочек атомов и описывает, как электроны распределены вокруг ядра. Он играет важную роль в определении химических свойств элементов и возможности образования связей.
В химии, принцип Паули объясняет, почему атомы формируют молекулы и соединения. Электроны в атомах могут находиться в различных энергетических уровнях и подуровнях. Каждый энергетический уровень может содержать определенное количество электронов, и эти электроны заполняют подуровни по принципу запрета Паули.
Принцип запрета Паули также объясняет, почему атомы и молекулы имеют определенную форму и структуру. Электроны стремятся занимать энергетически наиболее выгодные орбитали, причем заполняют их сначала в соответствии с принципом запрета Паули.
Таким образом, принцип запрета Паули является одним из основных принципов, определяющих поведение частиц в атомах, молекулах и соединениях. Он позволяет объяснить, почему некоторые связи возможны, а другие — нет, и определяет основные характеристики элементов и соединений.


